【明報專訊】「鑽石恒久遠,一顆永流傳」,可能是全世界最成功的珠寶首飾宣傳語句,令女士們對這顆自然界中最硬、閃閃生輝的寶石情有獨鍾。其實鑽石本身是由碳原子組成,跟製成鉛筆芯的黑色石墨一樣,為什麼同樣是碳原子,兩者之間卻有天淵之別?
Van Cleef & Arpels L'ÉCOLE珠寶藝術學院首個海外分校最近在香港成立,開設各種和珠寶相關的課程,這次便找來兩位寶石專家跟大家解釋鑽石背後的科學。
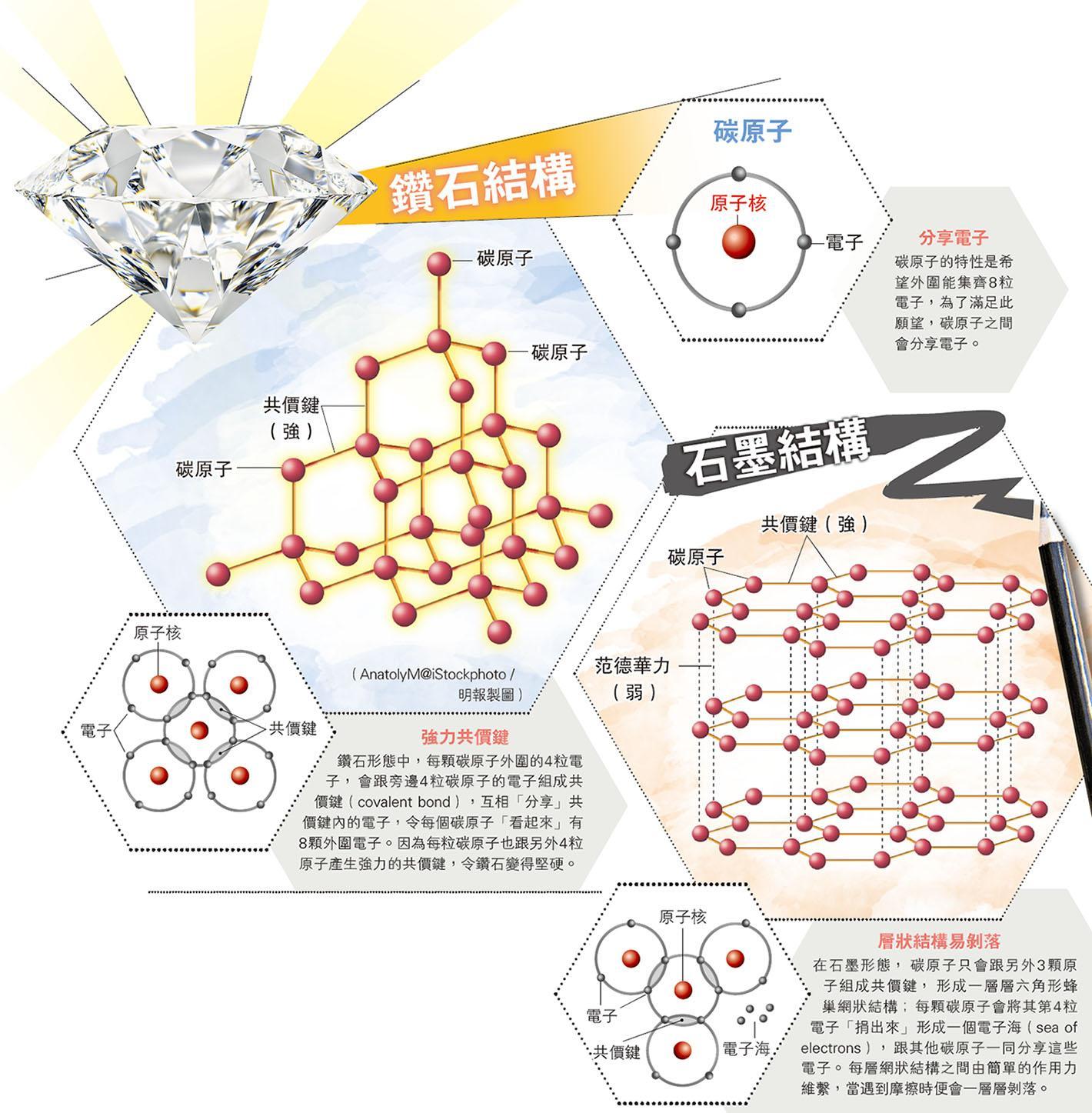
世上物質都是由原子(atom)組成,原子的排列方式和結構會影響物質的特性。同樣的碳(carbon)原料,可以鑽石的形態存在,像玻璃一樣完全透明,具有高度反射、折射率;但同時間也有燒烤用的木炭或鉛筆芯中的黑色石墨形態,這其實都跟碳原子的特別排列方式有關。
鑽石碳原子組成強力共價鍵
L'ÉCOLE珠寶藝術學院寶石學家吳飛洋解釋,在碳原子結構中,外圍有4粒電子(electron);而碳原子有一個特性,就是希望外圍集齊8粒電子,這樣它們會趨向穩定。為了滿足集齊8粒電子的願望,碳原子之間會以不同方法分享電子。在鑽石形態中,每顆碳原子會連結另外4顆碳原子,每顆碳原子外圍的4粒電子,會跟旁邊碳原子的電子組成共價鍵(covalent bond),碳原子會互相「分享」共價鍵內的電子,那樣每個碳原子「看起來」便有8顆外圍電子了。共價鍵是十分強力的連結,如果要將鑽石打散,便要同時斬斷碳原子跟另外4粒原子之間的共價鍵,那是相當困難,這也是為何鑽石能成為自然界中最硬物料的原因。
同樣由碳原子組成的石墨,每顆碳原子卻只會跟另外3顆原子組成共價鍵,形成一層層平面的蜂巢六角形網狀結構;而同時間每顆碳原子也將其第4粒電子「捐出來」,形成一個電子海(sea of electrons),由所有碳原子一同分享這些電子,令大家「自我感覺」有8粒電子。每層網狀結構之間由范德華力(Van der Waals force)維繫,來自分子之間的相互作用力,相比起共價鍵的力量則薄弱得多,所以當遇到摩擦時,一層層的石墨結構會輕易剝落,這正是石墨可以用作鉛筆芯書寫的原因。
高壓高溫生成天然鑽石
鑽石和石墨都是碳原子,但如何形成?天然鑽石於非常高的溫度和壓力環境下形成。通常發生在地幔的有限區域,距離地表以下約150至180公里,溫度至少為攝氏1050度;石墨則會在相對低溫低壓的情况下成形。除了較為人熟悉的鑽石和石墨,碳原子其實還有很多種不同形態,例如呈球狀的碳60(由60粒碳原子組成的球狀結構)和管狀的Carbon Nanotubes納米碳管,因為碳原子排列的分別,各有不同特性,在科技上也有不同應用,例如納米碳管可作為模具,內部填充金屬、氧化物等物質後再把碳層腐蝕掉,就可以製作出最細的納米尺度的導線,置於矽晶片上製作複雜的電路。
L'ÉCOLE珠寶藝術學院亞太區分校董事總經理Elise Gonnet-Pon說:「其實很多香港人對寶石、珠寶有很濃厚的興趣,這也是為什麼我們之前在香港舉行了3次短期課程後,決定在港開設永久分校的原因。」
◆專家意見:
.Élise Gonnet-Pon:L'ÉCOLE珠寶藝術學院亞太區分校董事總經理
.吳飛洋:L'ÉCOLE珠寶藝術學院寶石學家